2025年10月28日

香川大学医学部医学科6年生の森下陽香さん(写真)が、がん細胞の移動様式に関する研究成果をまとめた英文論文を筆頭著者として発表しました。学部在籍中に2本目となる快挙であり、がんの浸潤・転移メカニズムの理解に新たな知見をもたらすものです。
森下さんは2年次より、組織細胞生物学講座の荒木伸一教授(当時)の指導のもと、がん細胞の移動・浸潤に関する基礎医学研究に取り組んできました。細胞が移動する際には、移動方向に葉状仮足(ラメリポディア)を形成することが知られています。従来、ラメリポディアは平坦な細胞突起と定義されていましたが、森下さんらの研究により、先端にACTN4を豊富に含む多層膜ヒダを持つ特殊なラメリポディアが存在することが明らかになりました。この新しい構造は「ラッフル縁ラメリポディア(ruffle-edge lamellipodia:REL)」と命名され、浸潤性の高いがん細胞に特異的に見られることが判明しました。RELは、通常のラメリポディアよりも高い運動能を持ち、ACTN4ノックダウンによりその形成と細胞移動が抑制されることが示されました。この成果は、2024年にElsevier社の学術専門誌『Experimental Cell Research』に筆頭著者論文として掲載されています。
さらに今回、RELの形成と運動に関わる新たな分子として、モータータンパク質myosin-1e(Myo1E)を同定しました。Myo1Eは、PI3キナーゼが生成する膜脂質PI(3,4,5)P3に結合するドメインとアクチン結合部位を持ち、細胞膜とアクチン線維をリンクすることで、膜形状の変化と細胞運動に寄与すると考えられます。研究では、浸潤性肺がん由来細胞株A549にmApple-Myo1EおよびGFP-ACTN4を導入し、蛍光ライブセルイメージングによりMyo1EがRELの先端に局在することを確認。PI3キナーゼ阻害剤の添加によりMyo1Eの局在が消失し、RELのラッフル構造も平坦な突起へと変化しました。RNA干渉によるMyo1Eノックダウンでは、RELの形成が著しく抑制され、細胞移動能も低下することが、超解像顕微鏡、走査電子顕微鏡観察やwound-healing assayなど多角的な解析により明らかになりました(図1,2)。特に浸潤性の高いがん細胞では、RELにMyo1Eが多量に存在し、ATPを活用して活発な細胞移動を可能にしていると考えられます。さらに、RELの膜ヒダには細胞外基質(コラーゲン)を分解するメタロプロテアーゼが存在し、Myo1Eによる膜運動が細胞浸潤能を高めている可能性が示唆されました²)。
この研究により、Myo1EがRELの形成と運動に不可欠な分子であることが明らかとなり、がん浸潤性のバイオマーカーや治療標的としての可能性が期待されます。RELの発見からMyo1Eの機能解明に至る一連の成果は、悪性度の高い浸潤性がんの転移メカニズムの理解と新たな治療戦略の構築に貢献するものです。
本研究成果は、Oxford University Pressの学術専門誌 『Microscopy』(Volume 74, dfaf039)に掲載されました(オンライン版2025年9月26日公開, オープンアクセス)²)。
論文情報
1)Haruka Morishita, Katsuhisa Kawai, Youhei Egami, Kazufumi Honda, Nobukazu Araki:
Live-cell imaging and CLEM reveal the existence of ACTN4-dependent ruffle-edge lamellipodia acting as a novel mode of cell migration. Experimental Cell Research (2024), 442:11423
2)Haruka Morishita, Katsuhisa Kawai, Ayaka Noda, Youhei Egami, Nobukazu Araki:
Myosin-1e drives ruffle-edge lamellipodia formation and motility in A549 invasive lung cancer cells. Microscopy (2025), 74: dfaf039.

執筆論文を手に持つ森下陽香さん(右)と研究指導教員の荒木伸一理事・副学長(左)
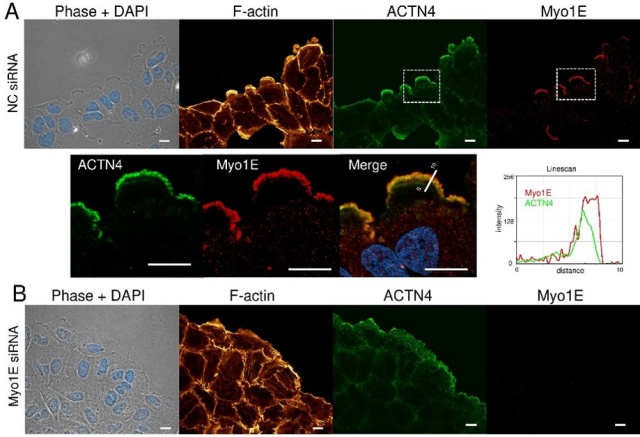
図1 A541細胞のMyo1EとACTN4の局在を蛍光免疫法で検出し超解像顕微鏡で観察。
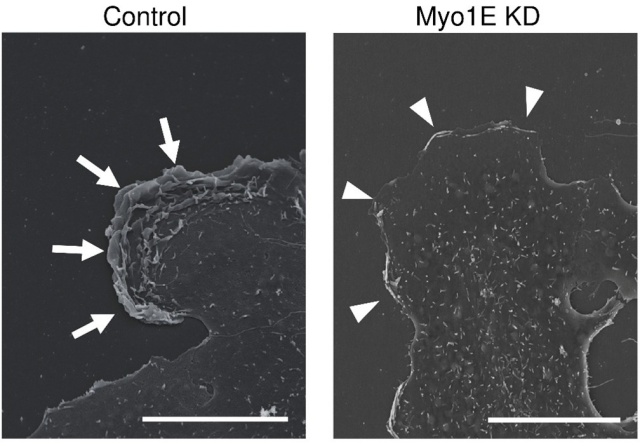
図2 A541細胞の走査電子顕微鏡観察。左のA541細胞(Control)のラメリポディアの先端には、多層の膜ヒダ(矢印)が観察されるが、右のMyo1Eノックダウン(MyoIE KD)A541細胞には多層のヒダ構造はほぼ見られない。スケールバーは10μm。
この研究は、JSPS科学研究費補助金(23K06306 代表:荒木伸一)を受けています。
COI:なし。
問い合わせ先
荒木伸一 理事・副学長 (教育担当)
(医学部 組織細胞生物学 教授 ※2025年3月まで)
760-0032 香川県高松市幸町1-1
araki.nobukazu@kagawa-u.ac.jp