 (Program MOLSCRIPT by Dr.Kraulisによる描画)
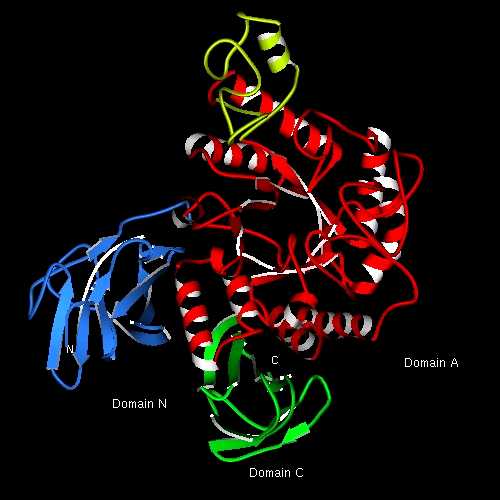
(Program MOLSCRIPT by Dr.Kraulisによる描画)好熱性放線菌(Thermoactinomyces vulgaris R-47)は、2つのα-アミラーゼ(TVAI, TVAII)を産出します。これらは、通常のα-アミラーゼがほとんど加水分解できないシクロデキストリンやプルランといった糖類も分解することができるという興味深い基質特異性を持っています。最近、当研究室では、TVAIIの3次元構造をX線結晶解析により明らかにし、その結果、TVAIIは、シクロデキストリンを認識できるPhe残基を活性部位付近に持つこと、TVAIIの活性部位は、他のα-アミラーゼに比べて浅く、プルランを認識するのに都合がよいことがわかりました。また、TVAIIは、通常のα-アミラーゼが持っていない新たなドメインをN末側に持つことが明らかになり、このドメイン(Domain N)が、結晶中でのダイマー構造形成の駆動力であると考えられました。しかし水溶液中でダイマー構造をとっているかどうか、Domain Nの基質特異性における役割など、未だ不明な点があり、それらの解明に向けて取り組むとともに、3次元構造情報に基づいた機能改変ミュータント酵素の分子設計および合成も行っています。 (Kamitori et al. (1999) J. Mol. Biol. 287, 907-921)
(Program MOLSCRIPT by Dr.Kraulisによる描画)